Дальтон Джон (1766-1844)
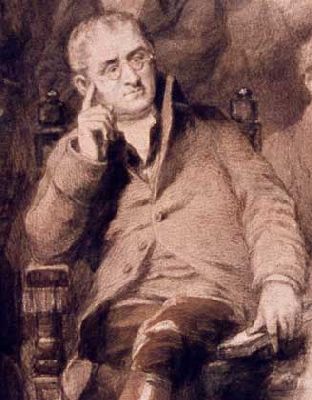
Английский химик Джон Дальтон прославился своей атомистической теорией и законами теоретической химии. Он родился на северо-западе Англии и был сыном ткача. Сначала учился у отца, а потом в местной квакерской школе, учителем которой в 12 лет стал сам. Через два года Джон начал помогать старшему брату руководить ближайшей школой. В 1793 г. Дальтон переехал в Манчестер, где преподавал математику в колледже, а потом начал давать частные уроки; это позволило ему проводить научные исследования.
В 1794 г. Дальтон описал цветовую слепоту, которой страдали они с братом; эту наследственную болезнь назвали дальтонизмом. Он изучал газы и атмосферу, с 1786 г. до конца жизни вел метеорологический дневник, куда вошло более 200000 наблюдений. Эксперименты с газами позволили ему в 1801 г. сформулировать закон парциальных давлений, гласящий, что давление смеси газов, химически не взаимодействующих друг с другом, равно сумме их парциальных давлений (т.е. таких давлений, которые бы оказывал газ, если бы занимал весь объем целиком).
В 1803 г. Дальтон выдвинул атомистическую теорию. Он утверждал, что элементы состоят из маленьких невидимых частиц (атомов), что все атомы одного и того же элемента одинаковы, а разные элементы состоят из разных атомов. Кроме того, атомы нельзя ни создать, ни уничтожить; химические соединения возникают тогда, когда атомы разных элементов соединяются в простых соотношениях. Он придумал символы для каждого из известных тогда 14 элементов, которыми можно было обозначать и соединения. Его модели из шариков и палочек до сих пор используются на уроках химии.
Год спустя (1804) Дальтон сформулировал закон кратных отношений: если два химических элемента образуют друг с другом больше одного соединения, то массы одного элемента, приходящиеся на одну и ту же массу другого, относятся как нецелые числа. Например, водород создает две окиси - воду (Н20) и перекись водорода (Н2Ог). В воде 2 г водорода соединяются с 16 г кислорода. В перекиси 2 г водорода соединяются с 32 г кислорода. Количества кислорода, соединяющиеся с одним и тем же количеством водорода, относятся друг к другу как 16:32, или как 1:2.